Um grupo de investigadores da Universidade de Newcastle, Inglaterra apresentou um novo método de captura e armazenamento de carbono (CAC), baseado num processo utilizado pelos ouriços-do-mar. O método baseia-se na utilização de nano partículas (partículas de tamanho muito, muito reduzido) de níquel para transformar o dióxido de carbono num ião, hidrocarbonato, solúvel em água e que pode facilmente reagir, levando à formação de depósitos de carbonato de cálcio ou de magnésio que podem ser mais tarde reutilizados (nomeadamente na construção civil) (Crédito: Lindsey Hesla/Nátional Geographic).
Apresentado a 5 de Fevereiro num artigo da revista Catalysis Science & Technology (CST), o novo método foi patenteado e os seus autores, Gaurav Bhaduri e Lidija Šiller, esperam conseguir investimentos externos para estuda-lo melhor e poder aplica-lo a nível industrial. Lidija Šiller, professora na School of Chemical Engineering and Advanced Materials, Universidade de Newcastle considera que este método “oferece uma oportunidade real para centrais térmicas e as indústrias de produção de produtos químicos para captar o dióxido de carbono antes de este gás chegar à atmosfera e armazena-lo como um produto seguro, estável e útil”
.
O dióxido de carbono é um gás libertado durante a combustão de carvão, derivados de petróleo e outros combustíveis. Mas é também um gás de efeito de estufa. O aumento do dióxido de carbono na atmosfera terrestre poderá provocar um aumento da temperatura média suficiente para tornar a vida impossível no nosso planeta. Atualmente uma das soluções apresentadas para contrariar a acção do dióxido de carbono é a CAC, que defende o armazenamento de dióxido de carbono de forma a não aumentar a sua concentração na atmosfera.
Até hoje os únicos métodos de CAC viáveis e utilizados a grande escala apontam para o armazenamento do dióxido de carbono em antigos reservatórios de petróleo ou de gás natural ou em massas de águas subterrâneas impróprias para consumo. E este tipo de armazenamento tem riscos sérios devido à possibilidade de fugas de gás, com consequências trágicas, como é demostrado pelo exemplo do lago Nyos (ver aqui e aqui – em inglês).
Assim vários grupos, incluindo o grupo de Bhaduri e Šiller, têm investigado métodos alternativos de CAS, como a mineralização do dióxido de carbono, ou seja, a sua transformação em carbonatos, como o carbonato de cálcio (giz, gesso e conchas de animais marinhos), carbonato de magnésio e a dolomite. Estes minerais não são tóxicos para o meio ambiente e têm várias aplicações possíveis, por exemplo a nível da construção civil, na produção de cimento, como material ornamental, etc.
O trabalho de Bhaduri e Šiller teve início numa descoberta acidental: ao estudarem o efeito tóxico de nanopartículas de prata em larvas de ouriço-do-mar (utilizado como “modelo ecotóxico”), estes investigadores descobriram que o seu exosqueleto (a sua “carapaça”) tinha uma grande concentração de níquel. Resolveram então estudar o contributo do níquel na transformação de dióxido de carbono em carbonato de cálcio (elemento importante do exosqueleto das larvas de ouriço-do-mar). “Quando se faz borbulhar dióxido de carbono na água contendo nanopartículas de níquel é possível ‘capturar’ muito mais carbono do que é normal”, refere Šiller. “Este carbono ‘capturado’ pode facilmente ser transformado em carbonato de cálcio.”
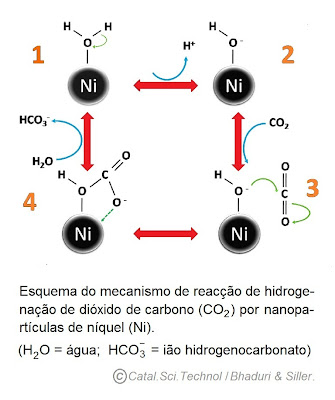
O artigo refere como o níquel catalisa a hidrogenação do dióxido de carbono, a sua transformação em ião hidrogenocarbonato, utilizando uma molécula de água (indicado na figura em baixo). Este é um passo importante na transformação de dióxido de carbono em carbonato de cálcio. Outros grupos têm estudado esta transformação realizada pela enzima anidrase carbónica, um catalisador biológico. Mas a utilização desta enzima tem várias desvantagens.
A ação da anidrase carbónica é reversível: quando o pH é básico (superior a 7) catalisa a transformação de dióxido de carbono em ião hidrogenocarbonato, mas quando o pH é ácido catalisa a reacção contrária. E como o ião hidrogenocarbonato é um ácido, rapidamente a anidrase carbónica passa a catalisar a reação contrária quando a concentração deste ião aumenta e o pH diminui. Para que a anidrase carbónica possa atuar “no sentido certo” e de forma eficiente, as condições de pH e de temperatura têm de ser constantes, o torna este processo economicamente menos viável. E finalmente a obtenção da anidrase carbónica também é um processo caro.
A utilização de nanopartículas de níquel também têm consequências menos positivas, principalmente para a saúde pública (são cancerígenas) e para o meio ambiente. Mas Bhaduri e Šiller consideram que é possível minimizar estes efeitos. “A beleza da utilização de níquel como catalisador é que o seu funcionamento não depende do pH e, devido às suas propriedades magnéticas do níquel, as nanopartículas podem ser recapturadas [utilizando uma espécie de íman] e reutilizadas vezes sem conta”, indica Gaurav Bhaduri, aluno de doutoramento. “Também é muito barato, 1000 vezes mais barato do que a anidrase carbónica”.
Outros dois factos que contribuem para tornar o processo mais económico, segundo Bhaduri e Šiller, é o facto de poder ocorrer a temperatura e pressão normais (tornando-o mais eficiente a nível energético) e não serem necessários reagentes para lá das nanopartículas de níquel. No artigo da SCT Bhaduri e Šiller indicam que o processo de captura de uma tonelada de dióxido de carbono poderá custar menos de 8 dólares (menos de 6 euros). Em Portugal as centrais termoeléctricas libertaram quase 7 milhões de toneladas de dióxido de carbono em 2012. Seriam necessários menos de 42 000 euros para transformar todo esse gás em carbonato de cálcio e/ou de magnésio.
No futuro Bhaduri e Šiller esperam poder melhorar o seu processo de CAC. “Temos esperanças que este método possa ser utilizado a nível industrial em processos que levam à emissão de dióxido de carbono, como fábricas e centrais eléctricas”, indica Šiller, “mas é necessário quantificar o processo para poder produzir um sistema piloto”. “Precisamos de conhecer melhor o processo cinético da reação catalizada pelas nanopartículas de níquel e o seu rendimento”, acrescenta Bhaduri. Mas sabem que o método que apresentam não é perfeito. “Não pode ser encaixado no tubo de escape de um carro, por exemplo”, aponta Šiller.

Sem comentários:
Enviar um comentário